La médecine a connu une évolution majeure au XXᵉ siècle avec l’essor des technologies et de l’analyse statistique des données. Pourtant, cette approche à l’échelle collective atteint ses limites lorsqu’il s’agit de personnaliser les soins. Le XXIᵉ siècle s’oriente ainsi vers une médecine prédictive et individualisée, nécessitant de nouveaux outils pour simuler ce système complexe qu’est le patient, de manière plus fidèle.
Les jumeaux numériques sont des répliques numériques dynamiques censées simuler l’évolution d’un organe ou d’une partie de l’organisme. Leur développement, encore émergent, repose sur des compétences complexes, offrant un terrain d’innovation aux ingénieurs souhaitant contribuer à la médecine de demain.
LE JUMEAU NUMÉRIQUE EN RADIOLOGIE INTERVENTIONNELLE : UN EXEMPLE D’APPLICATION
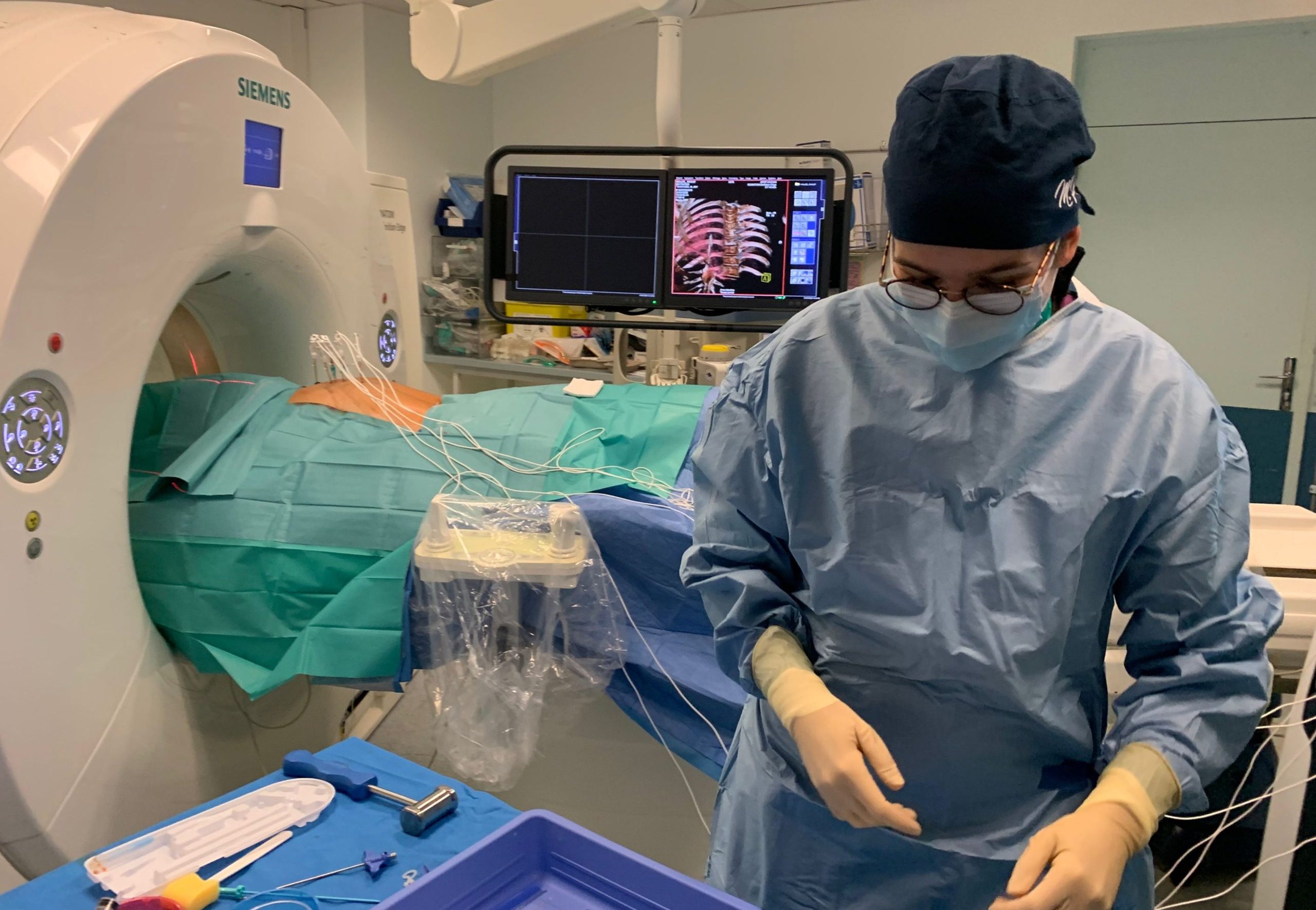
La radiologie interventionnelle est une branche de la radiologie dédiée à la réalisation d’interventions à but thérapeutique1 mini-invasives guidées en temps réel par des techniques d’imagerie (échographie, radiographie, scanner) et réalisées par des médecins radiologues. Ces traitements peuvent être vasculaires ou percutanés :
- Les traitements vasculaires sont des interventions réalisées en navigant du matériel très fin directement à l’intérieur des veines ou des artères. L’embolisation consiste à occlure des vaisseaux. À l’inverse, la thrombolyse consiste à désobstruer un vaisseau bouché (par exemple dans l’AVC).
- Les traitements percutanés sont des interventions réalisées en insérant des aiguilles directement à travers la peau, sans cicatrice, parfois sans anesthésie générale, et en évitant en grande partie les complications d’une chirurgie ouverte. Il est par exemple possible de cette façon de consolider un os fracturé (ou susceptible de se fracturer). Il est également possible de traiter un organe, pour détruire des cellules tumorales localisées ; par exemple, c’est l’ablation tumorale percutanée.
Il existe de multiples techniques pour détruire une tumeur à travers la peau :
- par effet thermique ; la radiofréquence ou les micro-ondes détruisent par le chaud, la cryothérapie détruit par le froid.
- par effet électrique ; l’électroporation applique un champ électrique qui rend les membranes cellulaires perméables de façon plus ou moins permanente.
- par effet chimique ; en injectant un agent toxique directement dans la tumeur.
L’électrochimiothérapie est une technique d’ablation tumorale percutanée, qui combine un effet électrique avec un effet chimique2. L’avantage de cette technique, relativement récente par rapport aux autres techniques d’ablation percutanée, réside dans sa capacité à épargner les cellules non tumorales. En particulier, cette technique offre la possibilité de traiter des tumeurs à proximité de zones anatomiques fragiles, comme la moelle épinière ou les nerfs (Figure 1).
L’électrochimiothérapie est une procédure réalisée actuellement en pratique clinique courante, dans des centres experts. Ce type de procédure comporte de nombreux paramètres (biologiques, physiques, pharmacologiques) qui sont autant d’incertitudes pour le médecin opérateur. L’objectif du jumeau numérique est de pouvoir simuler le déroulement de la procédure et la réponse au traitement, et donc de planifier l’intervention pour optimiser son résultat (Figure 2).
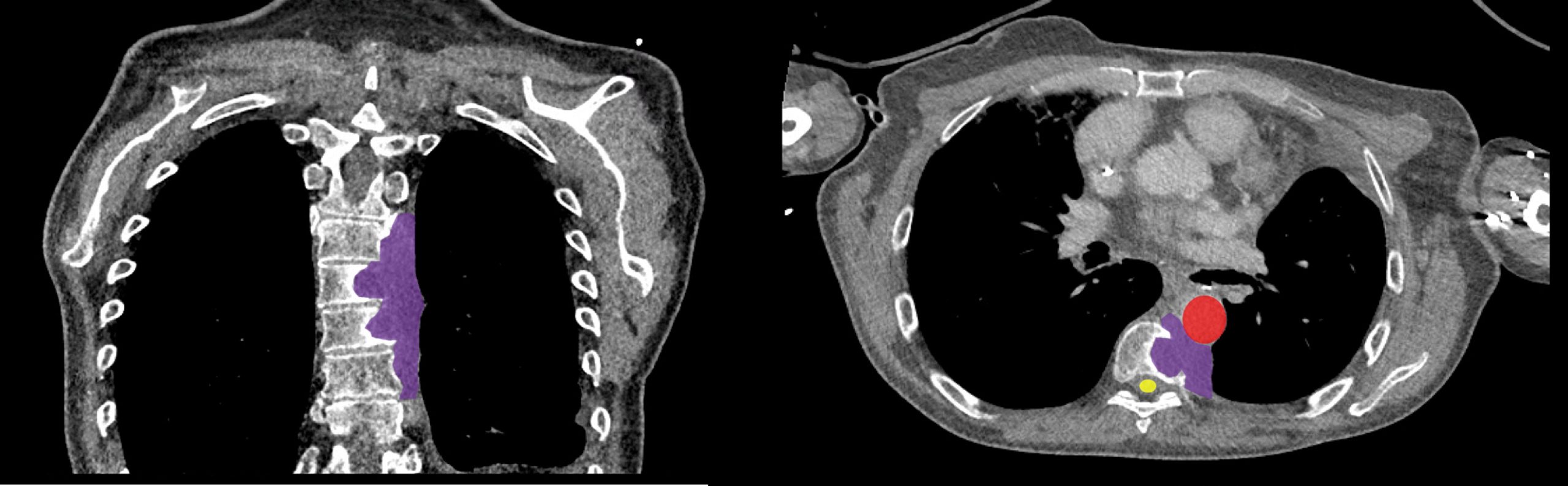
L’électrochimiothérapie, technique d’ablation tumorale percutanée, combine un effet électrique avec un effet chimique. Avantage : elle épargne les cellules non tumorales.
LE JUMEAU NUMÉRIQUE POUR LA PLANIFICATION THÉRAPEUTIQUE
L’usage d’un tel jumeau numérique a essentiellement deux objectifs pour le médecin opérateur : guider la réalisation technique de l’intervention ; et prévoir son effet thérapeutique. Dans le cas précis de l’électrochimiothérapie, le jumeau numérique doit intégrer au moins trois composantes techniques complexes pour répondre à ce double objectif.
Une composante géométrique : segmentation et modélisation 3D
Le rôle de l’opérateur consiste à positionner des électrodes autour de la tumeur (Figure 3). Le positionnement des électrodes est contraint d’une part par les structures anatomiques normales qu’il faut éviter (les nerfs, les artères, les organes, etc.) et d’autre part par les limites de la tumeur, qui sont parfois difficilement individualisables des structures normales, y compris sur les examens d’imagerie les plus avancés.
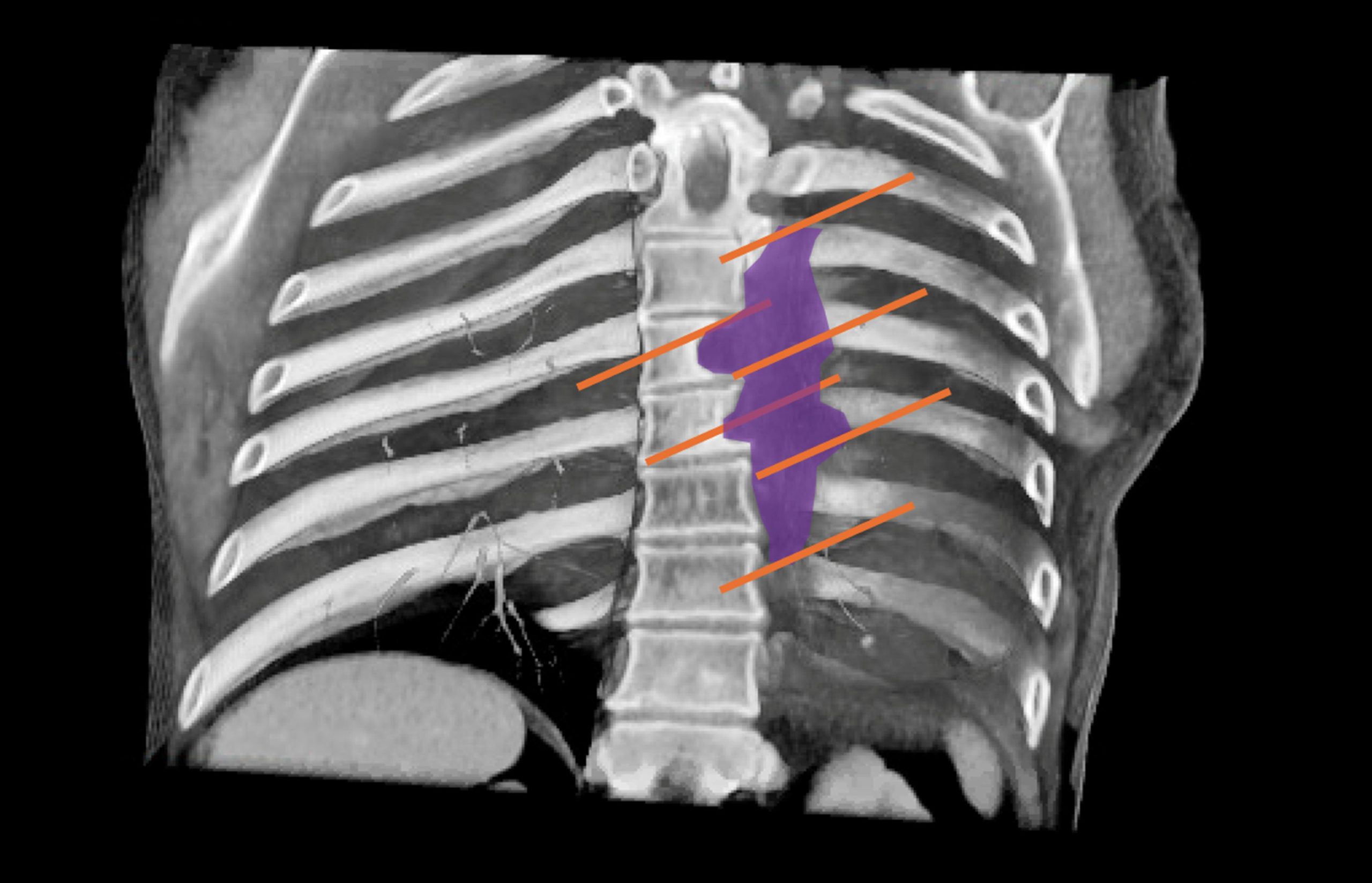
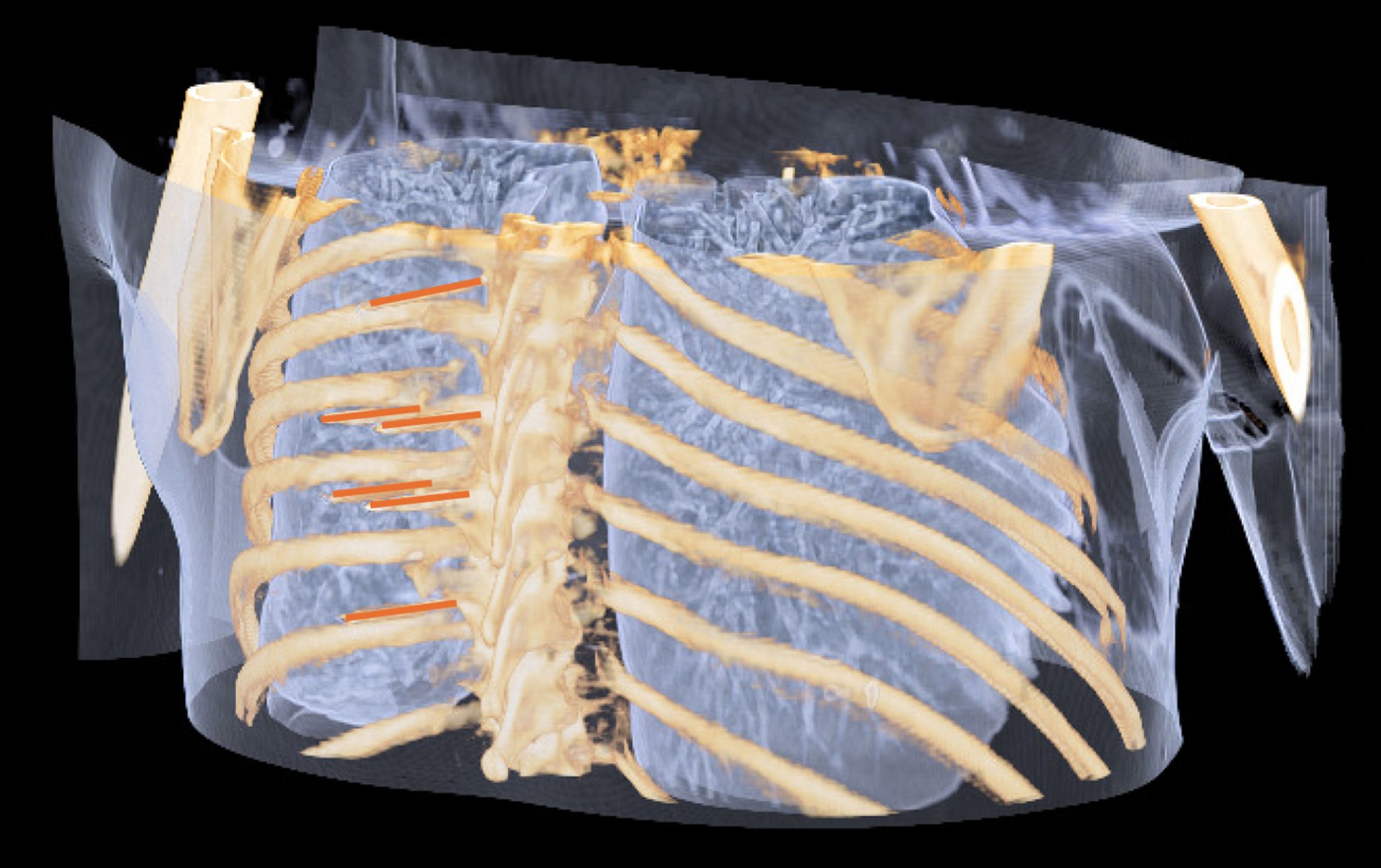
À l’heure actuelle, l’opérateur décide empiriquement du positionnement des électrodes, suivant sa propre expérience et l’hypothèse forte que la masse tumorale est globalement une boule, ou tout du moins un objet convexe, qu’on peut facilement circonscrire dans un cube. Pourtant dans la réalité, non seulement c’est rarement le cas, mais la simple visualisation d’un volume complexe à partir d’une imagerie visualisée en 2D est parfois un exercice périlleux. Certains outils existants permettent une segmentation du volume tumoral, plus ou moins automatisée. En revanche, le maillage en 3D du volume obtenu, nécessaire pour positionner les électrodes au mieux en évitant certaines zones anatomiques, est la première contrainte technique à intégrer au jumeau numérique (Figure 4).
Une composante physique : la modélisation du champ électrique
La distribution du champ électrique entre chaque paire d’électrodes est mal connue, d’autant plus quand celui-ci doit traverser un milieu hétérogène ou plusieurs milieux différents avec des interfaces plus ou moins perméables. Pour choisir un exemple classique, les tumeurs localisées dans l’os, les métastases osseuses notamment, peuvent être soit dans la moelle osseuse qui est au centre de l’os, soit sur la corticale osseuse qui est la partie rigide située en périphérie de l’os, et parfois la traverser. On connaît assez bien les propriétés mécaniques respectives de ces deux composantes osseuses3. En revanche, on ignore quasiment tout des propriétés électriques de l’os sain, et a fortiori de l’os tumoral. D’autre part, il existe probablement des différences de conductivité et de permittivité électrique en rapport avec le type de tissu tumoral. Chaque tumeur est différente et ne comporte pas le même type de cellules, et au sein d’une même tumeur, il peut coexister une grande hétérogénéité de cellules. Il est donc pratiquement certain que la composition du tissu tumoral influence la conduction du champ électrique dans le milieu et son effet sur la perméabilisation des membranes cellulaires. La modélisation du comportement électrique du milieu est donc un sujet complexe, encore non résolu.
Développer un jumeau numérique pour l’électrochimiothérapie nécessite une approche avec des compétences variées, allant de la segmentation et de la géométrie 3D à la simulation numérique de la distribution du champ électrique dans le milieu.
La composante chimique : la modélisation de l’effet pharmacologique
Dans l’électrochimiothérapie, une chimiothérapie permet de détruire les cellules tumorales. Comme pour toute chimiothérapie, il existe donc des notions de pharmacocinétique et de pharmacodynamique à prendre en compte pour que la concentration sanguine en médicament soit suffisante pour être efficace, sans atteindre des seuils de toxicité. En revanche, la concentration sanguine et la concentration cellulaire peuvent être très différentes. La concentration intra-cellulaire de chimiothérapie dans la zone soumise au champ électrique est dépendante de la perméabilisation cellulaire, donc de la conduction du champ électrique et des propriétés cellulaires du tissu tumoral. Le protocole de traitement actuel en électrochimiothérapie consiste à injecter la même molécule de chimiothérapie à la même concentration pour tous les types de cancers. Cependant, il est probable que l’électrochimiothérapie puisse servir dans l’avenir à vectoriser différents types de chimiothérapie, dédiés à chaque type tumoral.
En somme, développer un jumeau numérique pour l’application spécifique de l’électrochimiothérapie nécessite une approche avec des compétences variées allant de la segmentation et de la géométrie 3D à la simulation numérique de la distribution du champ électrique dans le milieu. L’approche statistique est aussi mise à contribution pour identifier les corrélations entre les paramètres techniques de la procédure (intensité du courant électrique, nombre d’électrodes et distance à la tumeur) et les effets thérapeutiques. Ces deux approches complémentaires nécessitent néanmoins de faire des hypothèses (parfois fortes) et de disposer de données de qualité, issues de pratiques harmonisées. Cet exemple illustre d’ailleurs la nécessité d’une transversalité de connaissances, et de collaborations étroites entre les métiers du soin et ceux des sciences.
CONCLUSION
Ces approches prédictives, outre le défi technique et intellectuel qu’elles présentent, sont également la promesse d’améliorer la précision et l’efficacité des traitements tout en limitant le risque de complications ou d’aléa thérapeutique. Travailler avec le vivant comporte une part d’incertitude que ni l’IA ni aucune autre technique avancée ne pourront réduire à zéro. Néanmoins, le patient, le médecin et le citoyen du XXIe siècle sont en droit d’attendre que la technique puisse augmenter l’humain pour prévoir ce qui est prévisible, détecter les signaux faibles et prévenir les risques d’erreur.


