Le traitement des larges défauts osseux demeure un défi non résolu par les sciences biomédicales. L’os naturel possède une capacité régénérative exceptionnelle, mais lorsqu’un défaut (fracture ou altération structurelle), provoqué par un choc traumatique, un cancer, une infection ou une anomalie génétique, excède le double du diamètre de l’os concerné, une intervention chirurgicale accompagnée d’une greffe est nécessaire.
L’ingénierie tissulaire osseuse peine encore à développer la greffe osseuse parfaite. Celle-ci doit allier une affinité pour les cellules osseuses (ostéoconduction), une dégradabilité permettant à la greffe d’être remplacée par de l’os sain au fil du temps, ainsi que des propriétés mécaniques (résistance, rigidité, dissipation d’énergie) équivalentes à celles de l’os naturel. Pour être utilisables en situation clinique, des formes complexes doivent aussi pouvoir être envisagées, afin de permettre au chirurgien d’avoir une approche spécifique au patient. Enfin, les coûts doivent rester attractifs pour intéresser l’industrie et garantir une mise sur le marché rapide.
L’arrivée récente de l’impression 3D a révolutionné beaucoup de domaines, y compris l’ingénierie tissulaire. De nouvelles architectures complexes sont désormais possibles, et la technologie offre également une gamme de matériaux compatibles avec ce mode de fabrication, répondant partiellement au cahier des charges : des polymères comme l’acide polylactique ou le polycaprolactone peuvent être imprimés en des supports ostéconducteurs à la porosité et au rythme de dégradation idéaux. En combinant ces polymères avec des céramiques, comme le phosphate de calcium, les propriétés mécaniques sont améliorées, mais sont encore loin de celles de l’os naturel. C’est ici qu’intervient l’approche biomimétique, visant à identifier et reproduire les éléments structurels clés de l’os naturel pour se rapprocher de ses performances mécaniques.
L’os, un matériau biologique minéralisé exceptionnel
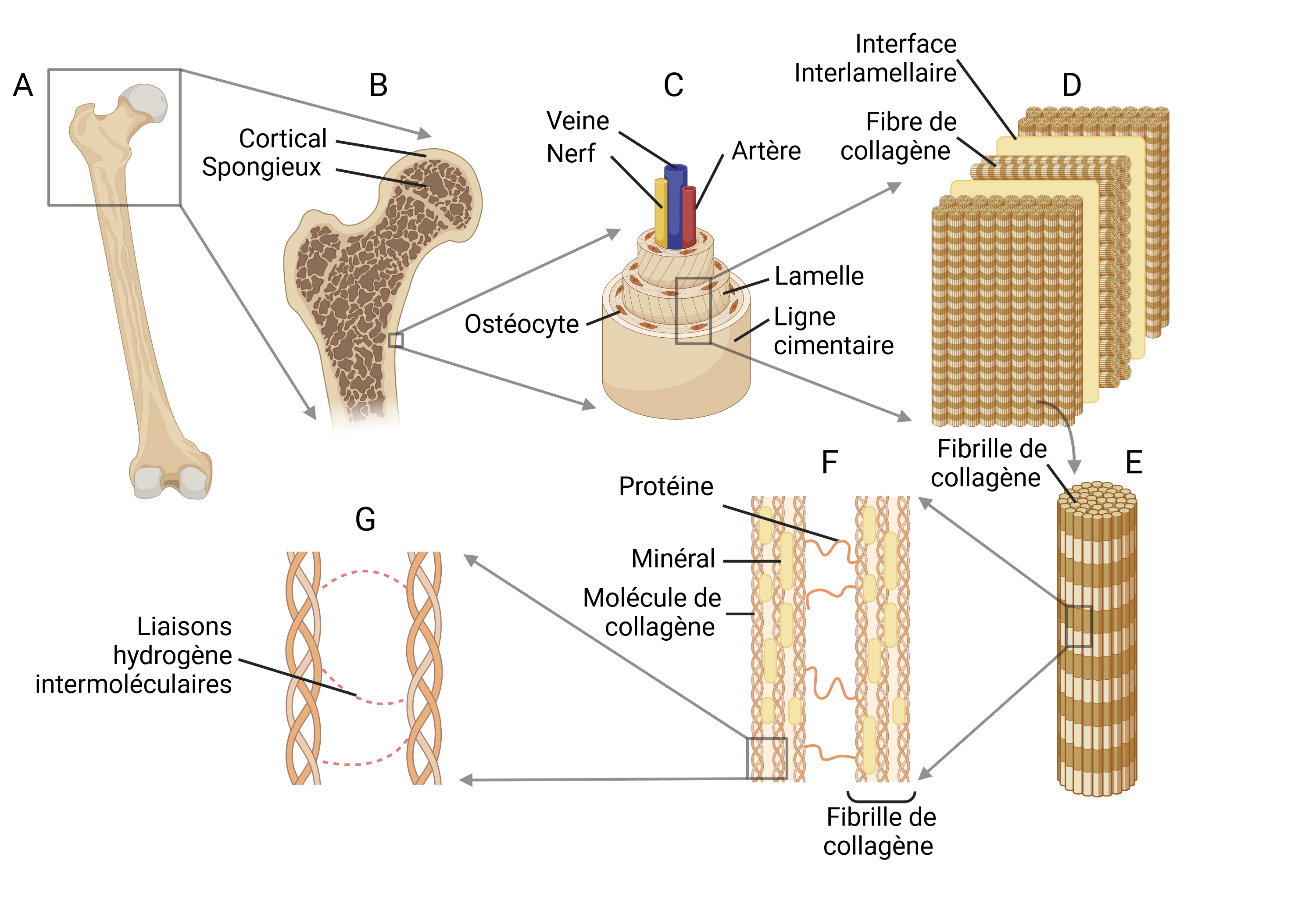
Le matériau osseux est constitué à 70 % d’un minéral, l’hydroxyapatite, responsable de sa rigidité (alors que les biomatériaux créés par l’homme peinent à dépasser 20 % de teneur minérale), et à 30 % d’une matrice polymérique souple, le collagène, brique élémentaire du règne animal. Un faible pourcentage d’autres protéines au rôle mécanique important viennent compléter cette composition. L’os cortical combine des propriétés exceptionnelles, comme sa résistance à la traction, similaire à celle de l’acier, tout en étant cinq fois moins dense. Cette parfaite optimisation est due à l’action simultanée des ostéoblastes, cellules osseuses construisant de l’os dans les zones où la contrainte est forte (en sécrétant des protéines et transportant du minéral), et des ostéoclastes, détruisant l’os là où la contrainte est faible afin de maximiser le rapport résistance-poids. L’organisation structurelle, en plus de la composition, joue donc un rôle prépondérant. Plus particulièrement, on observe dans l’os une architecture remarquablement complexe et hiérarchisée en sept niveaux, comme décrite sur la figure 1. Chacun de ces niveaux possède ses propres mécanismes de renforcement, dont la somme des contributions confère une spectaculaire capacité de dissipation de l’énergie qui freine la propagation des micro-fractures :
- Au premier niveau (figure 1A), se distinguent différents tissus (périoste, endoste, os, moelle osseuse).
- Au second niveau (figure 1B), l’os se divise en la partie corticale, très dense et soumise à de fortes contraintes, et la partie spongieuse, poreuse et légère. L’os spongieux se compose de trabécules dirigées selon les principaux stress biomécaniques.
- Le troisième niveau d’architecture pénètre l’échelle microscopique : les ostéons (figure 1C), structures en oignon (lamelles concentriques) encerclent le réseau artériel. Autour d’eux, une ligne cimentaire, plus minéralisée et donc plus cassante, accumule les dommages et contient les micro-fractures.
- Les lamelles sont le quatrième niveau (figure 1D), et se composent de fibres de collagène arrangées en différentes orientations, dans le but d’améliorer la résistance. Des protéines inter-lamellaires jouent elles aussi le rôle d’interfaces faibles qui gênent la propagation de fractures.
- Au cinquième niveau (figure 1E), la structure de la fibre de collagène se révèle être un assemblage de fibrilles de collagène, comme une corde se divisant en une multitude de fils.
- Ces fibrilles représentent le sixième niveau (figure 1F). Une fibrille est constituée de molécules de collagène piégeant des cristaux d’hydroxyapatite. Ces fibrilles sont déformables, et glissent l’une sur l’autre lors de fortes contraintes mécaniques. Ces fibrilles sont espacées d’un à deux nanomètres, et sont reliées par des protéines formant de faibles liens : l’ostéopontine et l’ostéocalcine. Ces liens se cassent lorsque la déformation l’oblige, mais se reforment. Ces liens sacrificiels, tel le velcro, dissipent à leur tour de l’énergie.
- Similairement, au dernier niveau (figure 1G), la molécule de collagène, structurée en triple hélice et longue d’un millier d’acides aminés, se lie à ses voisines par des liaisons hydrogène pouvant elles aussi se faire et se défaire, amortissant les déplacements moléculaires à l’échelle nanoscopique.
C’est la somme de toutes les contributions de tous ces mécanismes qui explique les propriétés observées à l’échelle macroscopique. Parmi elles, les interfaces faibles et leur capacité de dévier et d’arrêter les micro-fractures sont les plus grandes contributrices à la dissipation d’énergie. Leur principe est de combiner une phase souple en petite proportion avec une phase rigide et dure. Elle se retrouve dans d’autres matériaux biologiques minéralisés, comme la nacre de coquillage : des tablettes minérales très dures, en aragonite, y sont assemblées dans un réseau polymérique très mou, la conchyoline, ce qui permet de dissiper 3 000 fois plus d’énergie que les mêmes constituants isolés. L’intégration d’interfaces faibles dans les céramiques constitue ainsi la technique la plus prometteuse pour fabriquer des matériaux riches en céramique, mais non cassants.
Des céramiques multicouches à forte dissipation d’énergie
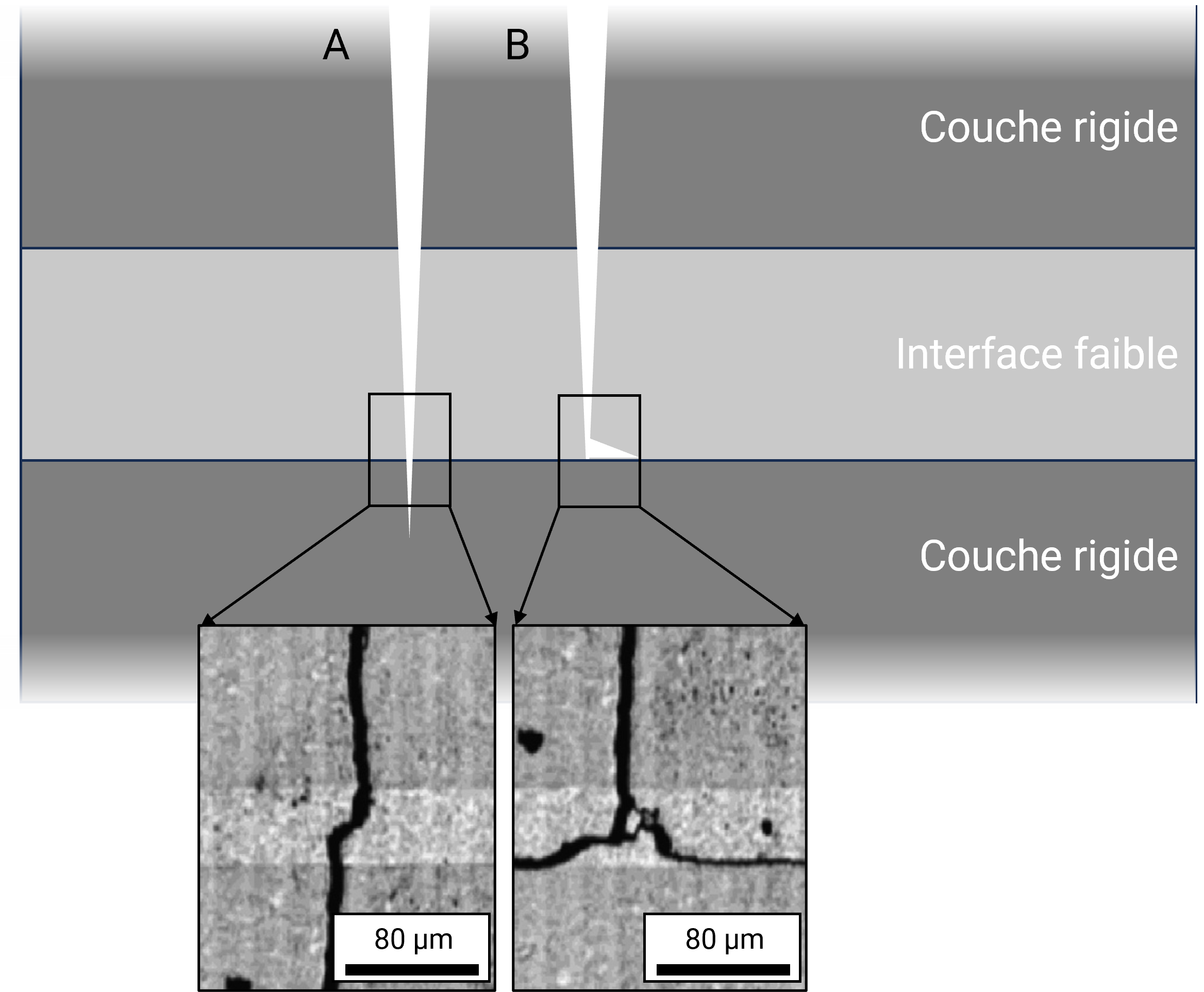
En mécanique de la rupture, un principe gouverne la propagation des fractures : celles-ci suivent le chemin de moindre énergie. Ainsi, on peut théoriser un matériau composite idéalisé, où alternent des couches rigides et des couches fines faites d’un matériau déformable (interfaces). Lorsqu’une fracture s’apprête à passer d’une couche rigide à l’autre (figure 2A), elle doit d’abord traverser une interface, où la propagation va demander moins d’énergie. La fracture peut alors parfois faire un virage en angle droit pour rester dans l’interface (figure 2B), et poursuivre sa propagation dans une direction perpendiculaire à la direction initiale. Tout en suivant ce chemin temporairement de moindre énergie, la fracture peut s’y piéger. Parfois, un défaut structurel dans la couche rigide peut influencer la trajectoire, et faire sortir la fracture de son interface, mais elle risquera de se faire dévier à nouveau autant de fois qu’elle rencontrera une interface faible sur son chemin. Le chemin tortueux finalement obtenu sera plus dissipateur d’énergie qu’une propagation rectiligne à travers toutes les couches, et parfois la fracture s’interrompt. Macroscopiquement, le matériau composite se plie sans rompre.
Mais à quel point l’interface doit-elle être “faible” et contraster avec la rigidité des couches minérales ? Ici “faible” doit être compris au sens énergétique, et correspond donc à la capacité de déformation et d’absorption de l’énergie. On parle de “ténacité” du matériau. Les équations du champ de contraintes autour de la pointe de la fracture démontrent que la ténacité des interfaces faibles doit être au moins 4 fois inférieure à celle des couches minérales pour pouvoir y dévier des fractures. Expérimentalement, du fait de l’imperfection des couches minérales, la probabilité de déviation est d’autant plus grande que l’interface est peu tenace. La figure 3 démontre ce concept, où des matériaux multicouches ayant des interfaces aux ténacités variées ont nettement affecté la propagation des fractures : rectilignement dans les interfaces trop tenaces, ou avec chemins très tortueux lorsque les interfaces étaient les plus faibles. Pour ce dernier cas, l’énergie totale dissipée par le matériau multicouche a été multipliée par un facteur 1000.
D’autres études expérimentales et numériques ont par la suite montré qu’un matériau multicouche à interfaces faibles était d’autant plus performant que le nombre de couches était élevé (pour augmenter les occasions de dévier les fractures) et que ses interfaces étaient fines (pour préserver les autres propriétés essentielles comme la rigidité ou la résistance).
Ainsi, cette approche biomimétique démontre que la reproduction expérimentale d’un seul mécanisme de renforcement observé dans les matériaux biologiques minéralisés est suffisante pour produire des matériaux composites riches en minéral, mais avec des capacités d’absorption de l’énergie démultipliées. Les matériaux naturels ayant ces mécanismes à divers niveaux d’échelle, leurs performances restent encore largement supérieures à celles des matériaux composites artificiels. La stratégie des interfaces faibles se trouve être malgré tout particulièrement adaptée aux applications d’ingénierie tissulaire osseuse, où des matériaux riches en minéral doivent être conçus pour répondre aux exigences d’ostéoconductivité et de biodégradabilité. La transition du théorique au prototype pourrait s’effectuer assez tôt, puisque les récents développements en impression 3D, comme l’impression de matériaux aux teneurs minérales variant jusqu’à 90 %, devraient permettre de réaliser de telles structures de manière fiable et répétable.




