
Historiquement au cœur de l’industrie pharmaceutique, les procédés de fabrication chimiques ne permettent malheureusement de produire que des “petites molécules”, composées de quelques dizaines d’atomes. Cela limite singulièrement leur potentiel. C’est pourquoi les biomédicaments, synthétisés non par chimie, mais par des cellules en culture, bouleversent l’industrie pharmaceutique traditionnelle. Le “bio” de biomédicament ne fait pas référence au terme anglais “organic” (agriculture biologique), mais au fait qu’ils sont produits par du “vivant”, des cellules cultivées dans des réservoirs : les bioréacteurs.
Ces biomédicaments sont composés principalement de protéines, molécules mille fois plus grosses que celles qui peuvent être obtenues par chimie. Le principe général : introduire dans des cellules en culture une séquence ADN contenant des gènes qui codent pour les protéines souhaitées (qui n’existent pas dans la nature la plupart du temps). Les classes de biomédicaments les plus connues sont les anticorps monoclonaux, les protéines recombinantes et les médicaments de thérapie génique.
En raison de leur potentiel thérapeutique très fort, ces médicaments prennent désormais le pas sur les médicaments traditionnels. En termes de revenus générés, ils ont atteint 500 Mds$ en 2023, et devraient dépasser ceux des médicaments traditionnels en 2027, pour atteindre 1000 Mds$ en 20301. Quant à la tendance de long terme, elle est claire : les biomédicaments représentent aujourd’hui 60 % des médicaments en cours de développement2.
UNE INDUSTRIE DE LA PRODUCTION SOUS TRÈS FORTE PRESSION
Très intéressants sur le plan thérapeutique, ce qui est fondamentalement le principal, les biomédicaments souffrent malgré tout d’un inconvénient très fort par rapport aux médicaments traditionnels : les rendements de production sont bas (voir ci-après).
Cela entraîne trois conséquences négatives majeures :
- L’abandon de nombreux candidats médicaments potentiellement efficaces : on estime que 25 % des candidats biomédicaments voient leur développement arrêté en phase de recherche amont (avant le début de tests cliniques), et ce uniquement en raison de difficultés de production ;
- Des retards très coûteux lors des essais cliniques : ces essais nécessitent la production de quantités significatives, et il n’est malheureusement pas rare qu’ils soient ralentis par manque de disponibilité dans les usines. Pour un médicament rapportant 1 Md$ par an, une semaine de retard conduit à une perte de 20 M$ ;
- Des coûts et investissements faramineux : du fait des faibles rendements, la production doit reposer sur de nombreux lots, et sur des consommables très onéreux (milieux de culture, résines…). À titre d’exemple, un essai clinique de phase 1 sur un biomédicament nécessite classiquement entre 3 et 5 lots de production, chacun d’un coût de l’ordre de 1 à 1,5 M$. Et ce besoin de nombreux lots conduit également à la nécessité de construire de nouvelles usines, pour un investissement de l’ordre de 1 Md$ si l’on compte la nécessaire certification des installations.
AU CŒUR DU PROBLÈME : LA PRODUCTIVITÉ DES CELLULES
La première étape du procédé industriel pour la production d’un biomédicament est la synthèse de la molécule utile par des cellules en culture (l’upstream). Une fois cette étape réalisée, de nombreuses et coûteuses étapes de filtration et purification sont réalisées (le downstream), avant la mise en forme du produit qui sera administré au patient (le fill & finish).
Améliorer l’efficacité de la productivité des cellules, la première étape, c’est naturellement améliorer celle de l’ensemble de la chaîne. C’est pourquoi de nombreux investissements ont été réalisés depuis 20 ans dans l’amélioration (malheureusement incrémentale) des lignées cellulaires, dans les milieux de culture, dans les machines de cultures cellulaires elles-mêmes…
Les concentrations (typiquement 5 à 10 g/L) obtenues à l’issue de cette phase d’upstream sont un argument de vente pour les entreprises proposant des services de production à l’industrie pharmaceutique, et leur compétitivité est souvent liée à la productivité des lignées cellulaires qu’elles utilisent.
Ce problème est d’autant plus critique que, pour des raisons d’efficacité des biomédicaments et de tolérance pour les patients, ce sont des lignées cellulaires de mammifères qui sont utilisées dans 90 % des cas, malgré leur bien plus faible productivité par rapport aux levures, et encore plus par rapport aux bactéries3.
UNE INNOVATION DE RUPTURE : LA SYNTHÈSE D’ARNM
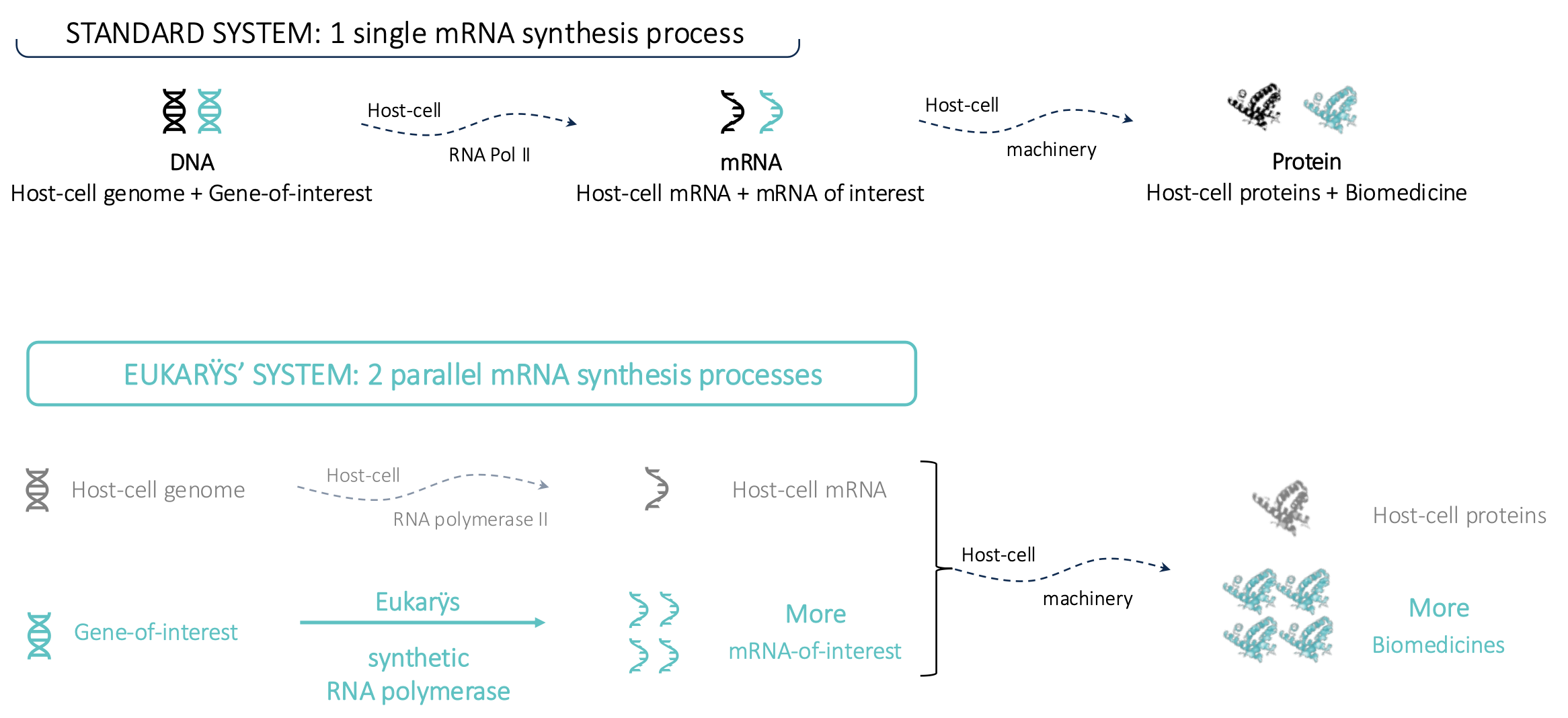
Dans les cellules, la synthèse du biomédicament (l’output) à partir d’une séquence ADN contenant des gènes d’intérêt (l’input) passe par une molécule intermédiaire : l’ARN messager (ARNm). Or les capacités de synthèse par les cellules de mammifères sont limitées, et comme la cellule synthétise peu d’ARNm d’intérêt (celui qui correspond au biomédicament), elle produit in fine peu de biomédicament.
Cette limitation provient de deux facteurs. D’une part, l’enzyme de synthèse d’ARNm de la cellule, l’ARN polymérase II, a une vitesse de synthèse relativement limitée. D’autre part il y a une compétition entre le génome propre de la cellule et les gènes d’intérêt pour y avoir accès.
Pour résoudre ce problème, la startup Eukarÿs a eu l’idée de créer une seconde voie de synthèse d’ARNm dans la cellule, capable de fonctionner en parallèle de celle de la cellule : pendant que l’ARN polymérase II de la cellule est mobilisée par son propre génome, une autre ARN polymérase, artificielle, serait dédiée à la synthèse de l’ARNm d’intérêt. Celle-ci devrait bien entendu être par ailleurs bien plus processive que l’ARN polymérase II de la cellule. Et une fois synthétisé en grandes quantités, cet ARNm d’intérêt serait utilisé par la cellule selon sa voie naturelle pour produire en plus grandes quantités le biomédicament visé.
Il fallait donc créer une enzyme de synthèse d’ARNm capable de fonctionner dans les cellules en culture, avec trois propriétés fortes :
- De très bons rendements
- Un système de reconnaissance des gènes d’intérêt4 pour n’agir que sur ceux-ci, et ainsi ne pas perturber le fonctionnement de la cellule
- Le plus dur : la capacité à réaliser les modifications très complexes que doivent subir les molécules d’ARNm5 une fois synthétisées, qui sont cruciales pour la traductabilité (la synthèse ensuite du biomédicament).
Il a fallu 13 ans de recherche fondamentale pour réaliser cette prouesse : là où plusieurs grandes universités américaines avaient pourtant échoué, Eukarÿs a mis au point le premier système de synthèse d’ARNm mature dans des cellules de mammifères, l’enzyme C3P3.
Et les résultats sont bien là : les cellules deviennent hyper productives, leurs rendements de production de biomédicament sont multipliés par un facteur 5 à 7 (voir Figure 1).
Le lecteur attentif aura remarqué qu’à aucun moment il n’a été fait mention du type de biomédicaments. Cette enzyme est capable de synthétiser de l’ARNm à partir de n’importe quel gène, donc pour n’importe quel biomédicament : cette technologie est universelle. Elle est par ailleurs sans impact à la fois sur les cellules et sur la qualité du biomédicament (heureusement !).
Cette technologie est arrivée à maturité en 2024, après le déploiement d’un prototype (aujourd’hui utilisé en routine) dans une entreprise pharmaceutique du top-5 mondial, et dans 25 laboratoires académiques de premier plan (Stanford, NIH…). Elle bénéficie par ailleurs de 9 publications scientifiques6, et de 3 familles de brevets à l’international. Mais une innovation de rupture n’est rien si elle n’est pas déployable aisément dans les unités industrielles…
PENSER LE DÉPLOIEMENT INDUSTRIEL
Puisque c’est la présence de l’enzyme C3P3 dans les cellules produisant le biomédicament qui les rend hyper productives – et que comme toute enzyme, C3P3 a la structure moléculaire d’une protéine, et doit donc elle-même être synthétisée dans une cellule (à partir d’un gène spécifique) – deux déploiements industriels étaient possibles :
- soit en deux étapes : d’abord synthétiser l’enzyme C3P3 dans des cellules et la collecter, puis la faire pénétrer dans les cellules produisant le biomédicament ;
- soit en une étape : en laissant les cellules produisant le biomédicament synthétiser elles-mêmes l’enzyme, et devenir ainsi “constitutivement” hyper productives.
C’est ce second process qui a été choisi. Bien plus simple à déployer, cette approche ne nécessite donc ni équipement supplémentaire ni changement de process industriel. Elle peut par ailleurs se greffer sur n’importe quel process, en totale complémentarité de toutes les autres technologies de production existantes, puisqu’aucune n’adresse le sujet de la synthèse d’ARNm par la cellule en culture, et que cette synthèse est une étape biologique qui ne peut pas être contournée.
Par ailleurs, un système plug&play a été mis en place pour pouvoir utiliser cette technologie sans adaptation pour n’importe quel biomédicament : il suffit d’insérer les gènes d’intérêt dans une “cassette”, selon une procédure très simple et rapide.
Enfin, sur le plan commercial, elle autorise un business-model de licensing-out (licences non exclusives) permettant un passage à l’échelle rapide, ainsi qu’une rentabilité très forte, similaire à celle de l’industrie du logiciel.
PROCHAINES ÉTAPES
Du fait de sa puissance et de son universalité, cette technologie a le potentiel pour s’imposer assez rapidement comme un standard de la bioproduction. Le chemin pour y arriver passe par trois étapes.
La première vient d’être franchie : sur la base du prototype déployé avec succès, un premier produit commercial a été sorti fin 2024. Il s’agit d’un plasmide (brin d’ADN circulaire) contenant le gène de l’enzyme C3P3. Ce plasmide peut être utilisé à des fins de recherche sur de nouveaux médicaments, par simple transfection (pénétration) dans les cellules en culture, et sur la production à des échelles industrielles, par intégration stable du gène de l’enzyme dans le génome des lignées cellulaires dédiées à la production du biomédicament.
La seconde étape est l’établissement par Eukarÿs de sa propre lignée cellulaire intégrant le gène de l’enzyme dans son génome. Prévue pour fin 2025, cette lignée servira notamment de démonstrateur d’intégration stable du gène de l’enzyme C3P3. Cela ouvrira 50 % du marché mondial (100 Mds$ de coûts de bioproduction à optimiser en 2023, le double en 2030) : tous les biomédicaments développés dans les lignées cellulaires des grandes entreprises pharmaceutiques, des grandes CDMO (sous-traitants de fabrication de médicaments), et des fournisseurs de lignées cellulaires (amélioration des lignées qu’ils commercialisent).
La troisième est la création d’un dossier réglementaire pour la lignée développée en étape 2. Même si une lignée cellulaire n’a pas besoin d’être certifiée, les clients d’Eukarÿs seront plus prompts à adopter ses lignées s’ils disposent d’un dossier déjà validé par les agences sanitaires pour la certification de leur médicament. Cela permettra à la startup d’ouvrir les 50 % restants du marché.
Enfin, à terme, Eukarÿs envisage d’adapter sa technologie à la bioproduction dans d’autres espèces, pour adresser des marchés industriels autres : agroalimentaire (pain, bière…), production d’enzymes, cosmétique…



